金纳米粒子新型疗法,为结直肠癌治疗带来新希望
发光金纳米粒子(L - AuNPs)属于一类新型的发光纳米材料,近年来受到了相当多的关注。它们具有一系列特殊的物理化学性质,并且正在被探索,有望用于多种生物方面的应用。
随着高效光化学合成策略的发展,一个研究小组设计并构建了一种基于L - AuNPs细胞膜靶向的新型双光子光动力疗法(TP - PDT)光敏剂。
该团队由中国科学院遗传与发育生物学研究所(IGDB)的蒋宇强带领,与北京大学、海军军医大学第一附属医院(上海长海医院)和中国人民大学合作。这篇论文发表于《先进复合材料与混合材料》(Advanced Composites and Hybrid Materials)。
这种光敏剂被证实能通过诱导细胞焦亡和免疫原性细胞死亡(ICD),有效地对结直肠癌进行原位治疗,从而抑制肝转移和肿瘤复发。这为实体瘤的治疗提供了一种安全有效的新策略。
肿瘤复发和转移是癌症患者死亡的主要原因,大约90%的患者最终被这些并发症夺去生命。完成治疗面临的关键挑战在于肿瘤微环境中的酸性和免疫抑制状况。
为克服这一问题,有必要解除(消除)免疫抑制并激发全身性抗肿瘤免疫反应。然而,抗肿瘤免疫具有多方面的特性,涉及抗原释放、呈递和免疫激活等过程,这使得单一的治疗方法效果不佳。
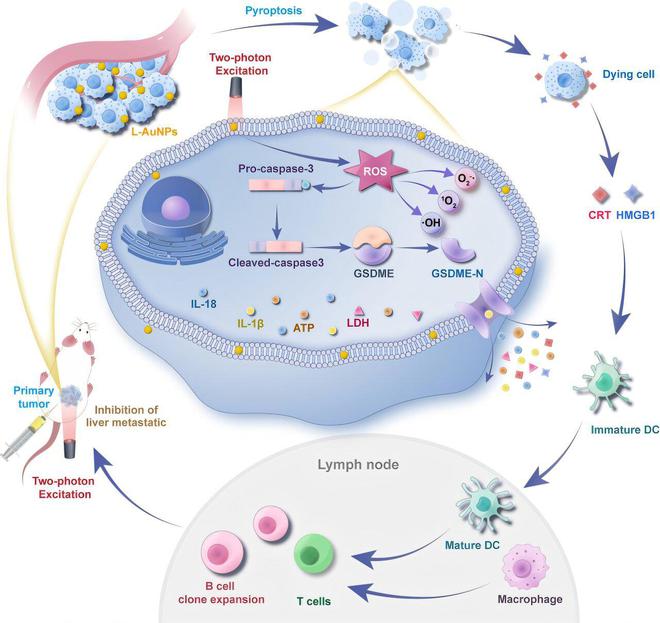
光动力疗法(PDT)利用光敏剂通过激光照射产生活性氧(ROS),从而破坏癌细胞。近期研究表明,由特殊设计的光敏剂参与的光动力疗法能够诱导细胞热解(细胞的热分解现象),并显著增强抗肿瘤免疫效果。
在这项工作中,研究团队开发了一种简便的光化学合成方法,用于制备表面包覆5 - 巯基 - 1,3,4 - 噻二唑 - 2 - 硫代乙酸(TMT)的发光金纳米粒子(L - AuNP@TMT)。研究表明,该探针具有显著的细胞膜靶向能力和显著的光动力治疗功效。
在近红外双光子激光照射下,L - AuNP@TMT能够高效地产生活性氧(ROS),包括超氧阴离子(O₂·⁻)和单线态氧(¹O₂),可有效消灭多种癌细胞,包括肝细胞癌和结直肠癌的癌细胞。
体内动物实验表明,在近红外照射下,L - AuNP@TMT诱导肿瘤细胞发生免疫原性细胞死亡(ICD)以及由半胱天冬酶 - 3/ gasdermin - E(caspase - 3/GSDME)介导的细胞焦亡,从而激活机体的抗肿瘤免疫反应,并在小鼠结直肠癌模型中实现有效的肿瘤抑制。
在63%的病例中,单次治疗就使肿瘤完全消失,在长达6个月的随访期内未观察到复发,这表明有显著的免疫记忆效应。
此外,L - 金纳米颗粒@TMT主要通过尿液代谢和排泄,没有明显的毒副作用,从而显示出良好的生物安全性。
新开发的金纳米系统不仅具有高效的光动力治疗性能,还能通过细胞焦亡和免疫原性细胞死亡激活宿主免疫系统,从而建立长期免疫记忆。有望解决实体瘤治疗和复发方面的难题。
