肿瘤免疫治疗这100多年的进展和挑战
Paul Ehrlich可能是最早提出免疫系统具备保护宿主免受肿瘤影响这一概念的。1909年,他设想免疫系统不仅会攻击感染性病原体,还会攻击肿瘤细胞以保护人体。下图展示了自20世纪初这100多年来,基础肿瘤免疫学和肿瘤免疫治疗药物开发的关键里程碑。
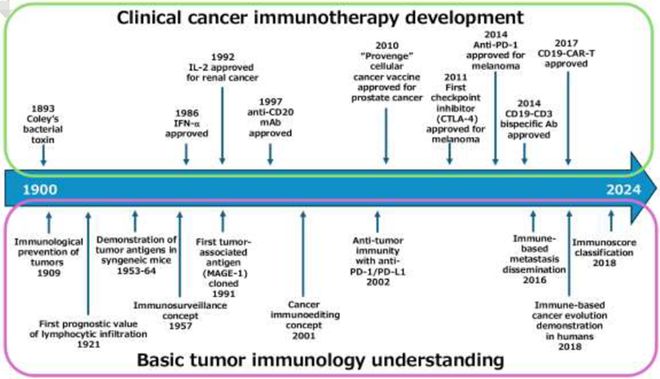
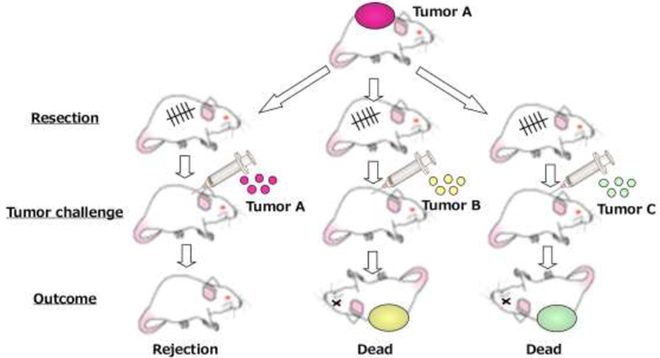
从20世纪50年代到60年代,包括Old、Foley、Prehn、Main和Klein在内的许多肿瘤免疫学家在同系小鼠中展示了肿瘤抗原的存在。同系小鼠的建立使研究人员能够检查肿瘤组织是否能被免疫系统识别为抗原性物质,这与免疫系统识别异体细胞的方式不同。利用同系小鼠及其化学致癌剂诱导的肿瘤,他们发现经过肿瘤A手术切除处理的小鼠对再次接种肿瘤A具有抵抗力,说明免疫系统识别肿瘤A,并产生杀伤作用。然而,这些小鼠对肿瘤B或C仍然易感。
Frank Macfarlane Burnet和Lewis Thomas于1957年提出了癌症免疫监视概念。他们认为T细胞可能是免疫系统对癌细胞反应的关键哨兵,并保护宿主免受癌症侵扰。这一概念引发了持续了半个多世纪的争论。争论焦点主要围绕是否存在有效的对抗肿瘤的免疫反应。因为直至21世纪的前十几年,肿瘤免疫治疗药物的临床开发几乎全部失败。
随着对细胞因子等可溶性因子在免疫反应中认识的增加,IFN-α被用于治疗包括慢性髓系白血病在内的多种恶性肿瘤,并于1986年获得美国FDA批准。IL-2在1976年被报道为“T细胞生长因子”,也被用于治疗癌症患者,并于1992年获得FDA批准。然而,这些细胞因子疗法并未显著改善治疗结果,其应用也未扩展到多种肿瘤类型。
单克隆抗体在恶性肿瘤治疗中的首次成功是抗CD20单抗利妥昔单抗在B细胞淋巴瘤患者中的应用。利妥昔单抗于1997年获得FDA批准用于治疗B细胞非霍奇金淋巴瘤,并后来被批准用于其他疾病,包括慢性淋巴细胞白血病。尽管利妥昔单抗在这些疾病中表现出不错的疗效,但CD20并非肿瘤特异性抗原,单抗治疗的应用也未扩展到其他肿瘤类型。
1991年,Boon等人克隆了MAGE-1,这是首个被T细胞识别的人类肿瘤相关抗原。此后,许多肿瘤相关抗原被鉴定出来,使得针对这些抗原的肿瘤特异性免疫疗法(如肿瘤疫苗和肿瘤细胞疗法)的开发成为可能。然而,除了2010年在美国获批用于治疗前列腺癌患者的Provenge®治疗性肿瘤疫苗外,其它治疗性疫苗在临床试验中陆续失败。大量基础研究结果明确支持肿瘤免疫反应的存在,但有效免疫疗法的临床开发却面临困难,其原因尚不完全清楚。
肿瘤免疫编辑概念
Schreiber等人在淋巴细胞缺陷的RAG2基因敲除小鼠、IFN-γ基因敲除小鼠和STAT1基因敲除小鼠中进行了化学致癌剂诱导的肿瘤发生试验。观察到,与免疫健全的小鼠相比,淋巴细胞缺陷和IFN-γ不敏感小鼠的肿瘤形成更早且发生率更高。而且,随着年龄增长,RAG2和RAG2 STAT1双敲除小鼠的自发肿瘤发生率增加。证实了机体对肿瘤的免疫监视确实是存在的。
然而,事情到这还没结束。他们从经致癌剂处理的健康鼠和RAG2 基因敲除小鼠中取瘤,然后重新接种到动物体内。在RAG2基因敲除宿主中,来自WT小鼠和RAG2基因敲除小鼠的肿瘤均以相同的方式持续生长。然而,在健康宿主中,60%来自RAG2基因敲除小鼠的肿瘤持续生长,而剩余40%的肿瘤未见生长。100%来自健康小鼠的肿瘤在健康动物中成功成瘤。表明,在RAG2 基因敲除小鼠中形成的肿瘤从未经历过免疫选择,因此当转移到免疫健全小鼠中时,40%的肿瘤细胞被清除。免疫系统保护宿主免受高免疫原性肿瘤的侵害,留下免疫原性较低的肿瘤。
Schreiber等人将这一过程称为肿瘤免疫编辑,以更精确地描述发育中的肿瘤与免疫系统之间的相互作用。他们提出了肿瘤免疫编辑的三个阶段:消除、平衡和逃逸。在消除阶段,许多新生的肿瘤被先天和适应性免疫系统清除。有时,肿瘤细胞并未被完全清除,但在平衡阶段被免疫细胞控制后无法迅速进展。与此同时,基因不稳定性使肿瘤细胞能够发生改变,潜在帮助肿瘤细胞逃避或抑制免疫系统,这时将进入逃逸阶段。在此阶段,它们在没有免疫系统控制的情况下持续生长,形成大量肿瘤病灶。基于这一概念,我们可以理解许多临床上诊断的晚期肿瘤其实已经处于逃逸阶段,此时肿瘤已经形成了免疫抑制和/或免疫逃逸表型,对免疫攻击具有抵抗力。
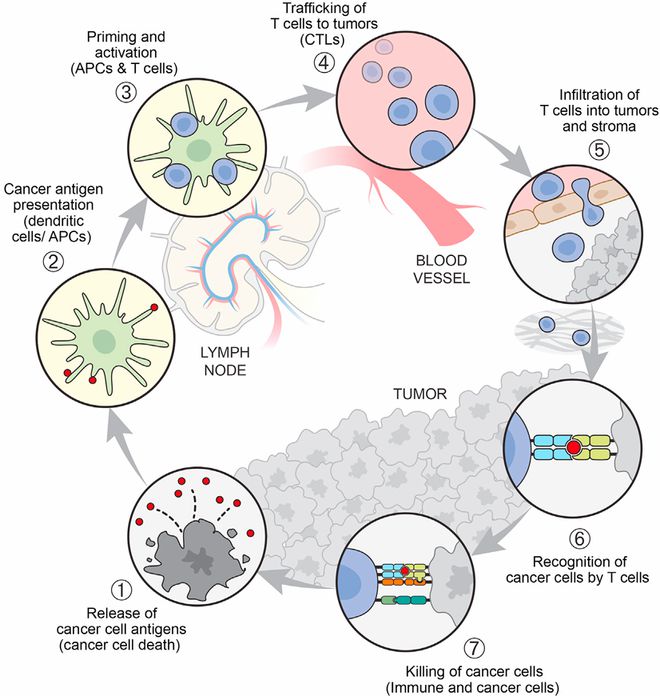
Chen和Mellman于2013年提出了肿瘤-免疫循环,描述了免疫系统有效清除癌症所需的过程,并于2023年进行了更新。将循环分为七个步骤。第一步是从死亡肿瘤细胞中释放肿瘤抗原。第二步是肿瘤抗原呈递给抗原呈递细胞(APCs,如树突状细胞)。第三步涉及APCs在淋巴结等部位激活T细胞。第四步涉及T细胞通过血液迁移到肿瘤部位。第五步涉及T细胞的外渗和浸润到肿瘤中。第六步涉及T细胞通过T细胞抗原受体(TCR)识别癌细胞。第七步是利用T细胞的细胞毒性机制杀死癌细胞。当癌症-免疫循环进展到第七步时,它会启动一个新循环,作为肿瘤杀伤的正反馈。然而,他们发现每个步骤中都存在许多抑制因素,这些因素可以阻止肿瘤-免疫循环的运转。在临床肿瘤治疗的真实场景中,更多是需要对抗处于逃逸阶段的肿瘤。
肿瘤免疫治疗的临床突破
《科学》杂志将肿瘤免疫疗法评为2013年的“年度突破”。这一评选是基于免疫检查点抑制剂(ICI)和过继性T细胞疗法的成功。免疫检查点分子是受体,能够传递共刺激或抑制信号,调节T细胞TCR的主要信号。阻断CTLA-4和PD-1的抑制信号,在多种肿瘤患者中显示出显著的抗肿瘤效果。2011年,一种抗CTLA-4单克隆抗体Ipilimumab被FDA批准为首个用于治疗黑色素瘤的检查点抑制剂。2014年,一种抗PD-1单克隆抗体Nivolumab被批准用于治疗黑色素瘤,后来又用于治疗NSCLC、肾细胞癌、霍奇金淋巴瘤和头颈部鳞状细胞癌等。目前,ICI被用于治疗多种肿瘤类型,非常广谱,包括黑色素瘤、NSCLC、肾细胞癌、霍奇金淋巴瘤、头颈部癌、胃癌、恶性间皮瘤、Merkel细胞癌、肝细胞癌、乳腺癌和微卫星高度不稳定(MSI-H)实体瘤。T细胞耗竭是肿瘤免疫治疗中的一个重要障碍。ICI被认为可以抑制和/或逆转肿瘤微环境中肿瘤特异性T细胞的耗竭。免疫检查点抑制剂在癌症临床治疗中的成功,有力地证实了克服临床肿瘤在逃逸阶段的免疫抑制和/或免疫逃逸表型的重要性。
继免疫检查点抑制剂的成功之后,表达CAR基因的T细胞过继性细胞疗法也取得了优异的临床表现。CAR基因由特异性识别肿瘤细胞表面分子的抗体单链可变区(scFv)和CD3ζ以及共刺激分子(如CD28或4-1BB)的细胞内信号结构域组成。2017年,CD19-CAR-T细胞疗法被批准用于治疗急性淋巴细胞白血病和弥漫大B细胞淋巴瘤。2022年,FDA批准了B细胞成熟抗原(BCMA)CAR-T细胞用于治疗多发性骨髓瘤。Blinatumomab是一种CD19-CD3双特异性抗体,它通过将白血病细胞和宿主T细胞连接在一起发挥作用,会产生类似于CAR-T细胞攻击,也称为T细胞连接器(TCE)。Blinatumomab于2014年被批准用于治疗B细胞急性淋巴细胞白血病。截至目前,已经有多款CAR-T和TCE药物陆续上市。
肿瘤浸润淋巴细胞(Tumor-Infiltrating Lymphocytes,TIL)疗法是一种过继性细胞免疫疗法。从患者自身的肿瘤组织中分离出来的淋巴细胞,这些细胞已经浸润到肿瘤微环境中,并具有识别和攻击肿瘤细胞的能力。分离出的TIL在体外进行大量扩增,之后被重新输回患者体内,这些细胞能够在体内继续识别和攻击肿瘤细胞,从而发挥抗肿瘤作用。2024年2月16日,首款TIL细胞疗法——Lifileucel(商品名:Amtagvi)已获得FDA的加速批准,用于治疗经免疫检查点抑制剂治疗后进展的不可切除或转移性黑色素瘤成人患者。
利用T细胞克隆的TCRα和β基因(这些基因特异性识别肿瘤抗原)改造T细胞的TCR-T细胞疗法虽然尚未获批,但在针对滑膜肉瘤患者的临床试验中,针对NY-ESO-1抗原显示出明显的抗肿瘤反应。
这些过继性细胞疗法之所以有效,可能是因为它们能够绕过癌症-免疫循环中的几个步骤,这些步骤中抑制因素可能限制了患者体内大量效应T细胞的产生。再次提醒我们如何在肿瘤的逃逸阶段对抗恶性肿瘤。
肿瘤免疫治疗存在的问题
尽管ICI疗法目前已应用于多个瘤种的治疗,包括血液肿瘤和实体瘤,但从中受益的患者比例在大多数肿瘤类型中仅为10%到30%。扩大ICI疗法的受益人群比例是一个亟待解决的问题。针对LAG3、TIM3、TIGIT等新分子的疗法正在开发中。与其他疗法(如细胞毒性药物和分子靶向药物)联合使用,或者多种ICI联合使用,可能会扩大其应用范围。选择合适的患者也是ICI疗法的一个重要问题。虽然PD-L1和肿瘤突变负荷等生物标志物已被使用,但还需要更多指标来精确选择能从治疗中受益的患者。
尽管CAR-T细胞疗法在造血系统恶性肿瘤患者,特别是淋巴系恶性肿瘤患者中比较成功,但开发针对实体瘤的有效CAR-T细胞进展缓慢。原因有很多,其中一个是缺乏适合CAR-T细胞靶向的理想抗原,即仅在肿瘤细胞表达,正常细胞不表达或很少表达的抗原。在靶向CD19和BCMA方面取得了成功,但它们都不是肿瘤特异性抗原,而是与细胞系相关的抗原,表达于恶性细胞和正常细胞中。由于B细胞和浆细胞至少暂时是可有可无的,因此针对这些靶点的CAR-T细胞能够以非常高效的方式杀死几乎所有肿瘤细胞。在非淋巴系造血系统恶性肿瘤中,很难找到这些抗原。在实体瘤中,识别可被CAR-T细胞靶向的可有可无的靶抗原极为困难。Claudin 18.2可能是为数不多的靶点之一,主要在正常胃黏膜的分化上皮细胞中表达,其在细胞间的定位具有极化特征,主要分布在细胞的顶端和侧面。这种极化定位使得它在正常胃黏膜中主要发挥细胞间连接和屏障功能,调节细胞极性和防止胃酸通过细胞旁路泄漏。在病理状态下,Claudin 18.2 的表达和功能可能会发生变化。例如,在胃癌等恶性肿瘤中,Claudin 18.2 的表达可能会增加,并且其定位可能会从细胞的顶端和侧面扩展到整个细胞膜表面。所以,Claudin18.2 CAR-T细胞更多会影响肿瘤细胞,对正常细胞杀伤相对小,安全性可接受。2025年3月3日,科济药业的Claudin18.2 CAR-T细胞疗法舒瑞基奥仑赛注射液治疗既往接受过至少二线治疗失败的Claudin18.2表达阳性的晚期胃/食管胃结合部腺癌纳入CDE突破性治疗药物品种名单。2025年5月将其纳入优先审评。2025年6月25日,向CDE递交上市申请(NDA),是全球首款且唯一一款提交NDA的用于治疗实体瘤的CAR-T细胞产品。
在实体瘤中,很难找到在所有肿瘤细胞中普遍表达的肿瘤特异性或肿瘤相关抗原,这引出了第二个问题,即肿瘤异质性。与造血系统恶性肿瘤相比,实体瘤的肿瘤异质性更为明显。实体瘤的微环境通常是免疫抑制性的,常被调节性T细胞(Tregs)、肿瘤相关巨噬细胞(TAMs)和髓系来源的抑制细胞(MDSCs)浸润。实体瘤的代谢环境对效应T细胞往往极为不利,而对癌细胞和Tregs则较为有利。实体瘤的血管环境不利于T细胞。要到达实体瘤,CAR-T细胞还需要具有归巢/迁移能力,这需要适当的迁移机制以及趋化因子和趋化因子受体之间的相互作用。T细胞耗竭是一个重要问题。由于CAR-T细胞和TCR-T细胞可以利用患者或第三方来源的非耗竭T细胞,与依赖患者重度耗竭的肿瘤特异性T细胞的其他疗法相比,这些疗法可能具有优势。然而,CAR-T细胞的耗竭已被报告为治疗失败的障碍之一。防止或逆转CAR-T细胞的耗竭是未来的重要挑战。
免疫疗法的个性化将不仅是CAR-T细胞疗法,而是所有肿瘤免疫疗法的一项重要课题。异质性和差异不仅存在于肿瘤内部,还存在于个体之间。不同个体的肿瘤在其环境、微生物群、宿主免疫系统、肿瘤的逃逸机制以及肿瘤异质性的特征方面都存在差异。如何实现精准医疗,使肿瘤治疗因人而异更加任重而道远。
参考自“Cancer immunotherapy in progress—an overview of the past 130 years”一文。





