肺癌丨HER2突变,即将迎来首款高效靶向药
研究方法
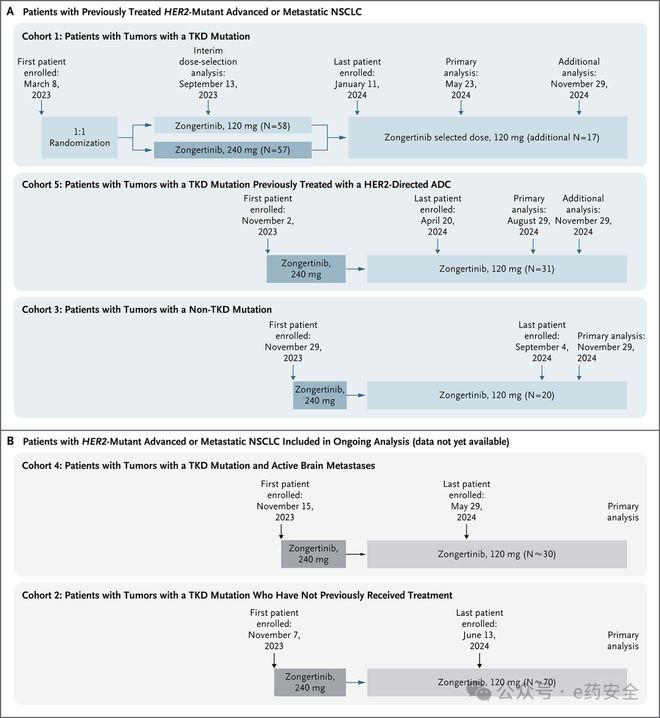
Beamion LUNG-1研究:是一项正在进行中的Ⅰa/b期试验,旨在评估Zongertinib在HER2阳性的晚期或转移性实体瘤(Ia期)和HER2阳性的晚期或转移性NSCLC(Ib期)患者中的安全性和有效性。Ⅰb期总共分为5个治疗队列,本次公布了1、3、5队列的临床结果。
Ⅰb期总共分为5个治疗队列,
队列1:酪氨酸激酶结构域突变的非鳞状NSCLC患者;
队列5:既往接受过HER2-ADC治疗,酪氨酸激酶结构域突变的非鳞状NSCLC患者;
队列3:非酪氨酸激酶结构域突变的非鳞状NSCLC患者或酪氨酸激酶结构域突变的鳞状NSCLC患者;
队列2:既往未接受过治疗,酪氨酸激酶结构域突变的非鳞状NSCLC患者;
队列4:有活动性脑转移,酪氨酸激酶结构域突变的NSCLC患者。

Beamion LUNG-1研究设计
纳入标准:年龄≥18岁;组织学或细胞学确诊为HER2突变型晚期或转移性NSCLC;有可测量病变;PS评分为0-1分;针对晚期或转移性疾病至少接受过一线包括铂类联合化疗在内的全身性治疗。有稳定或无症状脑转移的患者也符合标准。
研究终点:主要终点是根据RECIST 1.1版,通过盲法独立集中审核(队列1和5)或研究者审核(队列3)评估的客观缓解率。次要终点包括缓解持续时间、无进展生存期以及在基线时有脑转移患者的客观缓解率(基于RANO-BM评估)等。
研究结果
从2023年3月8日至2024年11月29日,队列1纳入132例患者、队列5纳入39例患者以及队列3纳入25例患者。这些患者在澳大利亚、欧洲、亚洲和美国74个试验中心接受了治疗。
01
队列1
既往接受过治疗的HER2酪氨酸激酶结构域(TKD)突变的患者(n=132);患者最初随机接受Zongertinib 120mg qd或240mg qd治疗。两种剂量的疗效相似,但接受240mg患者的严重不良事件发生率增加,导致更多患者中断用药或降低剂量,后期基于中期分析统一调整为120mg qd。
截至2024年11月29日,队列1的75例患者接受了120 mg剂量zongertinib治疗,其中44%的患者仍在接受治疗。基线时,其中超过三分之一(37%)的患者有脑转移。这些患者既往均接受过大量治疗;39%的患者既往至少接受过两种全身性治疗。

患者基线特征


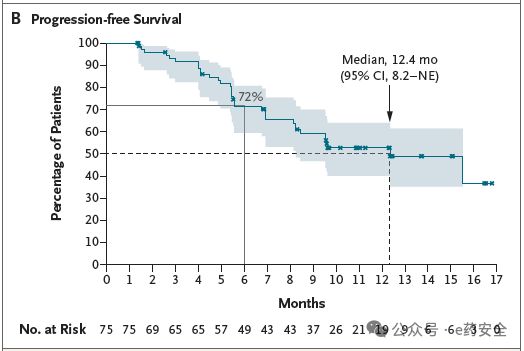
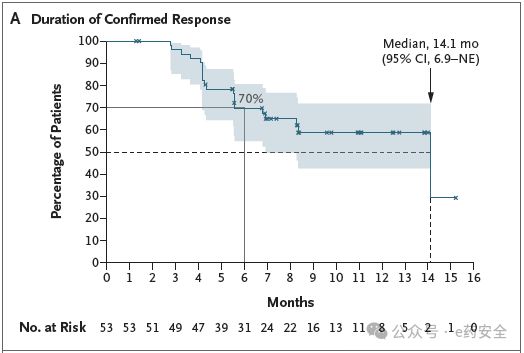
在120 mg剂量组(n=75)中,ORR为71%(95% CI,60~80),中位DoR为14.1个月,中位PFS达12.4个月。特别值得注意的是,在基线合并脑转移的患者(占37%)中,系统性ORR为64%(18/28),颅内ORR为41%。常见突变亚组(如A775_G776insYVMA)ORR高达81%。
PFS
DoR
另外,在55例接受240mg qd治疗的患者中,ORR为84%(95% CI,72-91),中位DoR和中位PFS分别为9.7个月和10.9个月,脑转移患者的颅内ORR为42%(10/24)。
安全性方面,zongertinib表现出良好的耐受性。队列1中≥3级药物相关不良事件发生率为17%,主要为可逆性肝酶升高(ALT升高8%、AST升高5%),未观察到药物相关间质性肺病事件。EGFR相关毒性(腹泻56%,皮疹33%)多为1~2级,仅1例患者因腹泻需减量。剂量比较显示,120 mg组在保持疗效的同时,其安全性优于240 mg组【≥3级腹泻2% vs 5%,导致减量7% vs 22%】,这一结果支持将120 mg作为推荐剂量。
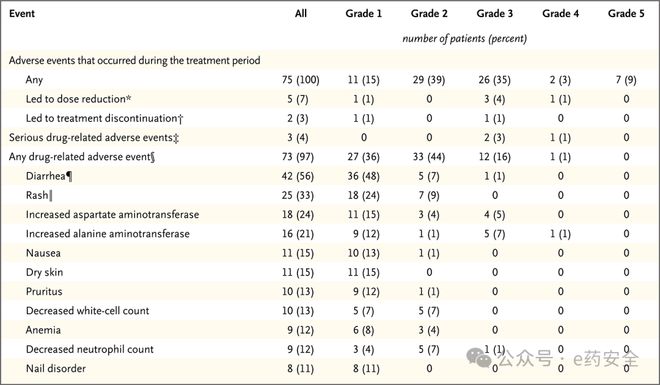
安全性
05
队列5
既往接受过HER2-ADC治疗的HER2突变患者(n=39例),其中纳入疗效分析的接受120 mg治疗31例。ORR为48%,中位DoR和中位PFS分别为5.3个月和6.8个月。其中22例患者之前接受过德曲妥珠单抗治疗,ORR为41%。
03
队列3
既往接受过治疗的HER2突变(非酪氨酸激酶结构域突变)患者(n=25例),其中纳入疗效分析的接受120 mg治疗20例,ORR为30%。
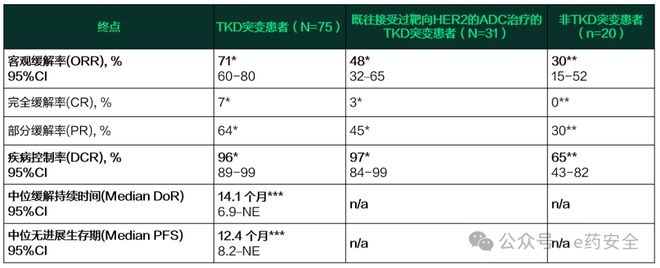
关键疗效终点总结